- dossierVaccin contre le zona (Shingrix) : efficacité, coût, effets secondaires
- dossierSyndrome de Gianotti-Crosti : éruption de boutons (cloques) après une maladie virale ou un vaccin
- dossierPeut-on attraper un rhume avec un baiser ?
- dossierÉpidémie du virus Marburg : faut-il s'inquiéter ?
- dossierVirus mortel Nipah : symptômes, transmission, zones à risque
Covid-19 : l'enquête sur l'origine du coronavirus
dossier Une équipe d’experts internationaux diligentée par l’OMS est arrivée en Chine. L’objectif, en visitant dans un premier temps Wuhan, la métropole où les premiers cas de Covid-19 ont été déclarés officiellement en janvier 2020, est de rencontrer des scientifiques chinois pour contribuer à identifier l’origine du virus SARS-CoV-2 responsable de la pandémie.
La crise du Covid-19 a démontré que les plans de préparation aux pandémies élaborés jusqu’alors ne suffisaient pas à contenir leurs expansions planétaires. Afin de réellement prévenir ce type d’émergences, il faut absolument développer ces stratégies avant que les virus ne commencent à se développer chez l’homme, c’est-à-dire dans le compartiment animal et à l’interface animal-homme.
C’est pourquoi il est en effet essentiel d’identifier l’origine, les processus évolutifs et les chaînes de transmission initiales qui ont conduit à la pandémie actuelle. Cela doit également être mis en regard des déterminants écologiques et économiques de cette émergence.
D'abord les chauves-souris

Il est considéré que les coronavirus transmissibles à l’homme et ayant émergé ces dernières années (SARS, MERS-CoV) circulent chez les chauves-souris et qu’ils ont été transmis à l’homme par des animaux hôtes intermédiaires (ou hôtes relais). On parle alors de zoonoses. Il est classiquement décrit pour les coronavirus zoonotiques l’intervention d’un animal domestique ou sauvage : le dromadaire pour le MERS-CoV, la civette palmiste à masque pour le SARS même si des doutes persistent sur le rôle de ce petit mammifère par rapport à d’autres animaux sauvages élevés en Chine.
L’Organisation mondiale de la santé (OMS) définit une zoonose comme une maladie ou une infection naturellement transmissible des animaux vertébrés à l’homme – et inversement. La pandémie actuelle causée par le SARS-CoV-2 a été classifiée zoonose, mais aucun réservoir ou hôte intermédiaire animal n’a encore été formellement identifié, de sorte que cette classification peut paraître prématurée pour certains auteurs qui identifient cette maladie comme une « maladie infectieuse émergente (MIE) d’origine animale probable »
Les premiers patients déclarés officiellement atteints de Covid-19 en Chine ont probablement été exposés au virus dans un marché de fruits de mer à Wuhan et certains des échantillons prélevés par écouvillonnage sur les surfaces et les cages du marché se sont révélés positifs pour le SARS-CoV-2, mais aucun virus n’a été isolé directement des animaux et aucun réservoir animal n’a été identifié pour le moment. Cependant, l’hypothèse est posée (piste animale) d’une évolution du coronavirus à partir d’un virus ancestral présent chez les chauves-souris et par l’intermédiaire d’un mammifère non encore identifié.
Beaucoup d’espèces différentes peuvent être infectées
Le virus a été détecté chez des animaux exposés à des humains infectés : chats, chiens et furets domestiques, lions et tigres en captivité, élevages de visons, ainsi que récemment chez des gorilles, ce qui témoigne d’une transmission possible de l’humain vers l’animal (zoonose inverse) et la réceptivité et sensibilité de carnivores, en particulier les mustélidés.
Une des hypothèses récentes sur l’hôte intermédiaire qui aurait permis l’évolution d’un virus ancestral en SARS-CoV-2, le virus de la Covid-19, porte sur les visons, élevés en Chine pour leur fourrure. En Chine, l’élevage d’animaux sauvages en captivité à des fins alimentaires, mais également thérapeutiques et pour la production de fourrures, a pris une importance considérable au fil du temps : il fait vivre plusieurs millions de personnes.
La production de fourrure a connu un développement accéléré en Chine depuis les années 1990 et la plupart des élevages se sont construits récemment, avec peu d’encadrement technique et vétérinaire. Son importance économique est devenue considérable, l’élevage d’animaux à fourrure employant environ 7 millions de personnes. Les principales espèces d’animaux à fourrure élevées en Chine sont le vison, le renard et le chien viverrin, dont les productions annuelles étaient estimées à 21 millions, 17 millions et 12 millions d’animaux abattus respectivement en 2018. Le secteur de l’élevage du vison est très hétérogène et peu structuré. D’après des estimations datant de 2016, près de la moitié des élevages sont des entreprises familiales de petite échelle détenant moins de 1000 visons, le reste est composé d’élevages de taille intermédiaire ainsi que d’une minorité d’élevages industriels intégrés comptant plus de 10 000 animaux (jusqu’à 52000).
La réceptivité et sensibilité de mustélidés, dont le vison d’Amérique (Neovison vison), au SARS-CoV-2, documentés dans le cadre de la transmission depuis des humains porteurs du virus, et en tenant compte d’autres éléments génétiques, économiques, écologiques et épidémiologiques, orientent les soupçons vers ces espèces : des travaux sur les récepteurs cellulaires (ACE2) montrent que de nombreuses espèces pourraient être réceptives au SARS-CoV-2 en particulier les primates ou des carnivores. Cependant les auteurs de cette étude recommandent de ne pas surinterpréter les prédictions avancées et que des données expérimentales et d’observation sur le terrain sont nécessaires.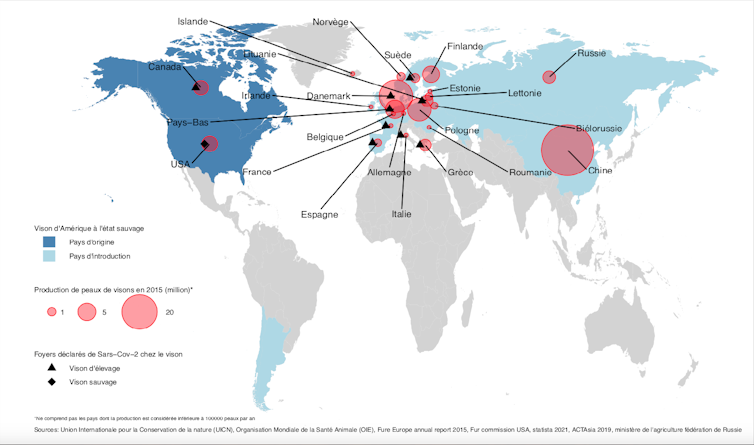

De manière générale, les émergences de maladies infectieuses, dont la fréquence a augmenté depuis le milieu du XXe siècle, sont favorisées dans les aires géographiques marquées par une augmentation de la pression exercée par l’homme sur les aires naturelles et une grande biodiversité animale, par la transformation des espaces naturels en terres agricoles, et par la chasse et la capture d’animaux sauvages. Dans les pays en voie de développement, au-delà des facteurs culturels, se sont bien souvent la combinaison d’une insécurité économique et d’une faible productivité de l’agriculture qui conduisent les populations rurales pauvres à prélever des animaux sauvages ou leurs produits, utilisés comme aliment (la viande de brousse), produit commercial, ou intrant agricole. C’est le cas du guano de chauve-souris, utilisé comme fertilisant en Asie du Sud-est.
Les élevages d’animaux (domestiques ou sauvages) favorisent la propagation et l’amplification de la virulence des pathogènes émergents, entre autres en raison du transport d’animaux sur de longues distances, et du stockage de fortes densités d’animaux à cycles de vie courts et souvent dans des conditions de biosécurité limitées. Par ailleurs les éleveurs, qui encourent des risques économiques élevés, suivent des logiques de minimisation des coûts qui peuvent faire obstacle à la détection et au contrôle précoces des maladies émergentes : les animaux présentant des symptômes cliniques sont vendus précocement. L’absence de transparence des filières animales permet bien souvent la commercialisation des animaux malades, mélangés avec des animaux sains.
Ces éléments permettent de mieux comprendre comment des élevages de visons auraient pu servir d’intermédiaire entre la chauve-souris et l’homme dans le cas du SARS-CoV-2. Ce phénomène a été observé dans le cas de la grippe aviaire, avec l’introduction du virus par le biais de contact avec les réservoirs sauvages (palmipèdes) asymptomatiques puis l’amplification de la maladie dans les élevages intensifs à forte densité, et la production au final de souches virales mutantes virulentes pour les animaux sauvages réservoirs initiaux.
Les facteurs économiques
L’acceptabilité des systèmes de surveillance sanitaire se heurte également à des logiques économiques, les éleveurs craignant l’impact des annonces de foyers de maladie sur les prix du marché et leurs possibilités d’exportation. En revanche, les abattages massifs des animaux d’élevage, parce qu’ils entraînent une augmentation des prix de vente, comme observés en Chine depuis les abattages de visons d’élevage au Danemark, augmentent paradoxalement les bénéfices des éleveurs non visés par ces mesures de contrôle.
Aux facteurs écologiques s’ajoutent donc des facteurs économiques fréquemment rencontrés dans les pays à revenus faibles et intermédiaires : insécurité économique des élevages ruraux pauvres, développement rapide de l’exploitation de la faune sauvage et d’élevages destinés à satisfaire une demande croissante en produits animaux, manque de transparence des filières agricoles.
Des études sont nécessaires dans une logique intégrée, One Health ou « Une seule santé ». Il s’agirait de rechercher virus et anticorps sur des échantillons collectés et stockés avant la pandémie de Covid-19 au travers de diverses études chez des animaux et des humains ; d’échantillonner dans les élevages de visons, mais aussi de chiens viverrins (Nyctereutes procyonoides) et de renards (Vulpes spp.) pour la recherche et le typage de coronavirus ; de mener des études épidémiologiques basées sur des sérologies spécifiques de la réponse au SARS-CoV-2 dans ces élevages, sur les animaux et populations humaines exposées ; d’analyser et modéliser la proximité entre chauves-souris et élevages de faune entre ces élevages et les populations humaines.
Des enquêtes sont nécessaires auprès des éleveurs d’animaux à fourrure sur leurs gestions des cas de maladies infectieuses : réponse (tentative de traitement, mise en vente sélective des animaux malades…) peut influencer le risque d’émergence chez l’homme. Des études relatives à l’organisation de la filière fourrure et ses liens avec les filières d’animaux ou produits d’animaux prélevés dans la nature sont à mettre en œuvre.

Des projets sur le terrain s’attachent à étudier les risques d’émergence de coronavirus à partir de la faune sauvage et de leur commerce. Ainsi le projet ZooCoV qui a débuté au Cambodge en associant le Cirad, l’Institut Pasteur du Cambodge et l’IRD doit contribuer à prévenir la transmission de coronavirus de l’animal sauvage à l’homme. Mentionnons également le projet Bat-CoV en Afrique.
À une échelle plus globale, il est nécessaire de prévenir les risques d’émergences zoonotiques et de pandémies. Ainsi l’initiative PREZODE, annoncée lors du dernier One Planet Summit en janvier 2021 s’appuiera et renforcera les coopérations existantes avec les régions du monde qui sont le plus confrontées à des risques d’émergences zoonotiques. PREZODE soutiendra l’intégration et le renforcement des réseaux de santé humaine, animale et environnementale, en phase avec l’approche « une seule santé » (One Health) afin de mieux évaluer et détecter les menaces d’émergences zoonotiques et de développer les actions de prévention avec l’ensemble des acteurs pour protéger les hommes, la planète, les socioécosystèmes et réduire ainsi les risques de pandémie.
Les experts mandatés par l’OMS devront explorer, en étroite collaboration avec leurs collègues scientifiques chinois, les diverses hypothèses sur l’origine du virus de la pandémie à Covid-19 : virus ancestral provenant d’un hôte naturel autre que la chauve-souris, hôte intermédiaire ou passage direct de l’hôte naturel à l’homme, virus trouvé sur le terrain puis échappé d’un laboratoire, etc., et celles donc relatives au rôle possible des visons ou autres animaux sauvages élevés pour leur fourrure.![]()
► François Roger, directeur de Rrecherche, épidémiologiste, Cirad ; Alexis Delabouglise, researcher, CIRAD ; Benjamin Roche, directeur de recherche, Institut de recherche pour le développement (IRD) et Marisa Peyre, deputy head of ASTRE research unit, Cirad.
► Cet article est republié à partir de The Conversation sous licence Creative Commons.